 Bài giảng Hóa hữu cơ - Chương 3: Hiệu ứng trong hóa hữu cơ
Bài giảng Hóa hữu cơ - Chương 3: Hiệu ứng trong hóa hữu cơiệu ứng cảm ứng động, ký hiệu Id Riêng trong dãy Halogen, Is và Id biến đổi ngược chiều (–Is) : –F > –Cl > –Br >–I (–Id) : –F < –Cl < –Br 3>2>1 do có hiệu ứng +I của các nhóm alkyl đẩy e vào N làm tăng mật độ e trên N nên dễ nhận H+ hơn
 15 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 963 | Lượt tải: 0
15 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 963 | Lượt tải: 0 Bài giảng Hóa hữu cơ - Chương 2: Liên kết hoá học trong hóa hữu cơ
Bài giảng Hóa hữu cơ - Chương 2: Liên kết hoá học trong hóa hữu cơYêu cầu kĩ thuật của bản vẽ chế tạo dao + Vật liệu chế tạo dao : Thép P18. + Độ cứng phần cắt đạt đợc sau nhiệt luyện : 62 65 HRC. + Sai lệch độ trụ của mặt trụ không quá 0,1 mm. + Độ đảo tâm theo đờng kính ngoài của : - Hai răng kề nhau : 0,04 mm - Một vòng quay của dao : 0,08 mm + Độ đảo mặt đầu ở điểm xa tâm lỗ nhất không quá 0,03mm. + Kiểm tra ...
 24 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 623 | Lượt tải: 0
24 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 623 | Lượt tải: 0 Bài giảng Hóa hữu cơ - Chương 1: Các khái niệm cơ bản và các phương pháp nghiên cứu cơ bản trong hóa học hữu cơ
Bài giảng Hóa hữu cơ - Chương 1: Các khái niệm cơ bản và các phương pháp nghiên cứu cơ bản trong hóa học hữu cơ+ Phản ứng cộng electrophil (ký hiệu AE): tác nhân electrophil tấn công trước. + Phản ứng cộng nucleophil (ký hiệu AN) tác nhân nucleophil tấn công trước. + Phản ứng cộng gốc tự do (ký hiệu AR) tác nhân gốc tự do tấn công trước. * Để chính xác hơn còn thêm các con số chỉ bậc động học của phản ứng. Ví dụ: - SN1 phản ứng thế nucleophil đơn phân tử - ...
 29 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 1061 | Lượt tải: 2
29 trang | Chia sẻ: hachi492 | Ngày: 07/01/2022 | Lượt xem: 1061 | Lượt tải: 2 Giáo trình Cơ sở lý thuyết hóa học - Phần thí nghiệm
Giáo trình Cơ sở lý thuyết hóa học - Phần thí nghiệm1. Nguyên tắc của phương pháp: Nguyên tắc của phương pháp đo pH là xác định nồng độ (chính xác hơn là hoạt độ, tuy nhiên dung dịch loãng thì có thể coi hoạt độ bằng nồng độ) của ion H+ trong dung dịch dựa vào sự thay đổi điện thế của điện cực thủy tinh (điện cực chỉ thị) là loại điện cực mà điện thế của nó phụ thuộc vào nồng độ của ion H+ trong ...
 35 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 931 | Lượt tải: 0
35 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 931 | Lượt tải: 0 Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 3: Liên kết hoá học và cấu tạo phân tử
Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 3: Liên kết hoá học và cấu tạo phân tửLực Vander Waals : c) Đặc điểm: của lực Van der Waals - Không chọn lọc không bão hoà - Năng lƣợng lk nhỏ (<40 kJ/mol) << lực lk cộng hoá trị và ion - Tăng nhanh khi khối lƣợng, kt phân tử và μ tăng Ts, T nc và ΔHhh ↑ khi kích thƣớc và khối lƣợng phân tử ↑ d) Vai trò: giữ vai trò quan trọng trong QT chuyển TT của các chất. Ví dụ: HF-HCl-...
 57 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 863 | Lượt tải: 1
57 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 863 | Lượt tải: 1 Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 2: Bảng tuần hoàn các nguyên tố hoá học
Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 2: Bảng tuần hoàn các nguyên tố hoá họcBiết cấu tạo vỏ electron suy ra vị trí và tính chất Ví dụ 2: Nguyên tố có Z = 35 Cấu hình electron của ngtử ngtố là: 1s22s22p63s23p64s23d104p5 - Nguyên tố thuộc CK 4 (vì n=4) - Là ntố p vì các e cuối cùng đang điền ở phân lớp 4p - Số e lớp ngoài cùng = 7 > 3 là PK, thuộc nhóm VIIA Biết vị trí trong HHTH cấu tạo vỏ electron Ví dụ 1: Nguyê...
 32 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 748 | Lượt tải: 0
32 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 748 | Lượt tải: 0 Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 1: Cấu tạo nguyên tử
Bài giảng Hóa học đại cương - Phần 1: Cấu tạo chất - Chương 1: Cấu tạo nguyên tửI.6.3. Viết cấu hình e của nuyên tử ở TTcơ bản: a. Dạngchữ: Ví dụ: Mn (Z=25) số e = Z = 25 1s22s22p63s23p64s23d5 Hay: 1s22s22p63s23p63d54s2 *) Mở rộng viết cấu hình e của ion: Mn3+ (Z=25) số e = 22 1s22s22p63s23p63d4 - Số e của ion ≠ Z - Khi điền e vào ngtử luôn điền theo nguyên lý vững bền nhưng khi ngtử mất e để trở thành ion thì...
 52 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 747 | Lượt tải: 0
52 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 747 | Lượt tải: 0 Bài tập môn Hóa đại cương
Bài tập môn Hóa đại cươnga) S(sp2),π không định vị,blk=1,5 b) S(sp2),π không định vị, blk=1,33 c) S(sp3),π không định vị,blk=1,33 d) S(sp3),π không định vị, blk=1,5II.12: 1CH3-2CH=3CH-4CH3 a) C1,C4(sp3); C2,C3(sp2) b) Cả 4C đều sp3 c) C1,C2(sp2); C3,C4(sp) d) C1,C4(sp3); C2,C3(sp) II.13: Sự hóa lỏng của NH3 : a) Lực khuếch tán b) Lực định hướng c) Lục cảm ứng d)...
 142 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 718 | Lượt tải: 0
142 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 718 | Lượt tải: 0 Tổng hợp trắc nghiệm Hóa học đại cương
Tổng hợp trắc nghiệm Hóa học đại cương48. Chọn câu sai A. Momen lưỡng cực phân tử là đại lượng vecto có hướng B. Trong phân tử nhiều ntử, momen lưỡng cực phân tử coi là tổng các vecto momen lưỡng cực liên kết C. Giá trị thực nghiệm của momen lưỡng cực đóng góp vào việc khẳng định lại cấu trúc phân tử D. Momen lưỡng cực phân tử chỉ phụ thuộc vào mmen lưỡng cực liên kết 49. Tro...
 14 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 779 | Lượt tải: 0
14 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 779 | Lượt tải: 0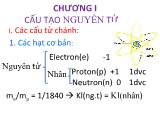 Bài giảng Hóa học đại cương (Bản hay)
Bài giảng Hóa học đại cương (Bản hay)a. phản ứng : AH n + NaOH → NaA + H2O C a,Va Cb,Vb Với Ca,Cb: nồng độ(CN) * Tại điểm tương đương (là thời điểm mà lượng chất cần chuẩn độ pư vừa hết với lượng chất chuẩn nhỏ từ ống nhỉ giọt xuống). Theo định luật đương lượng ta có: N A = NB CaCa = CbVb b. Để xác định điểm tương đương: dùng chất chỉ thị màu. Chất chỉ thị màu là chất c...
 196 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 711 | Lượt tải: 0
196 trang | Chia sẻ: hachi492 | Ngày: 06/01/2022 | Lượt xem: 711 | Lượt tải: 0
Copyright © 2026 Tai-Lieu.com - Hướng dẫn học sinh giải bài tập trong SGK, Thư viện sáng kiến kinh nghiệm hay, Thư viện đề thi


